Достаточно часто сталкиваемся с вопросом наших клиентов - как проверить в домашних условиях наличие белка в протеиновых продуктах?
В интернете множество разных видеороликов от неизвестных науке людей, утверждающих, что если в порошке присутствует белок, то при добавлении в него воды, достигшей состояния кипения, обязательно и во всех случаях должен начаться процесс денатурации (разрыв внутренней структуры молекулы белка приводящий к потере такого его свойства, как растворимость и, как следствие, влекущий коагуляцию продукта, то есть его свертывание).

Мы решили углубится в этот вопрос и рассказать Вам с научной точки зрения, насколько можно доверять "дедовскому способу" тестировать наличие белка в протеинах.
Забегая немного вперед, скажем сразу: В случае, если Вы добавите в купленный протеин кипяток и белок просто раствориться в воде - это вовсе не означает, что белка в порошке нет вовсе, и Вы купили подделку!
Свойства белков зависят от их строения
К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства.

Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
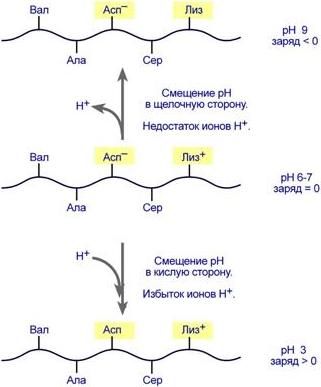
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативной конформации.
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
- наличием заряда и взаимоотталкиванием заряженных молекул белка,
- наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды

Комментарии
Ваш комментарий: